Zweistofflegierungen bzw. Binäre Systeme bestehen aus 2 Legierungselementen und sie werden im zweidimensionalen Zustandsdiagramm in Abhängigkeit von Temperatur und Zusammensetzung dargestellt. Dabei gibt es verschiedene Typen:
- Vollständige Unlöslichkeit im festen und flüssigen Zustand
- Vollständige Löslichkeit im festen und flüssigen Zustand
- System mit Peritektikum und Mischungslücke im festen Zustand
- Eutektisches System mit vollständiger Unlöslichkeit im festen Zustand
- Eutektisches System mit Mischungslücke im festen Zustand
Die mögliche Anzahl der gleichzeitig stabilen Phasen wird durch die Gibb’sche Phasenregel ausgedrückt. Betrachtet man den Druck als konstant gegeben, ergibt sie
sich zu F = K − P +1
F: Freiheitsgrade des Systems
K: Anzahl der Komponenten im Gleichgewicht
P: Anzahl der Phasen im Gleichgewicht
Daher können in einem Zweistoffsystem maximal 3 Phasen nebeneinander vorliegen, wie es im Eutektium der Fall ist. Ist F=0 ist dies ein Haltepunkt und F=1 ist es ein Knickpunkt.
Vollständige Unlöslichkeit im festen und flüssigen Zustand
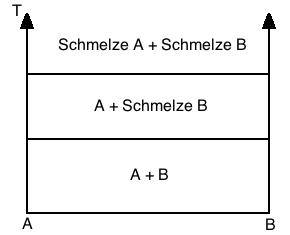
In diesem System sind die Komponenten z.B. durch einen unterschiedlichen Gittertyp vollständig unlöslich. Oberhalb der Liquiduslinie liegen zwei getrennte flüssige Phasen vor. Nach überschreiten der Liquiduslinie bei Abkühlung erstarrt zuerst A und B liegt immer noch flüssig vor. Bei weiteren Abkühlen und überschreiten der Soliduslinie erstarrt B und es liegen 2 getrennte feste Phasen vor, wobei die schwerere Phase sich unten befindet (Schwerkraftseigerung). Beispiel ist Fe-Pb.
Vollständige Löslichkeit im festen und flüssigen Zustand

Hier liegen im flüssigen und festen Zustand nur eine Phase vor. Wird eine solche Legierung abgekühlt scheiden sich bei überschreiten der Liquiduslinie Mischkristalle aus. Die Zusammensetzung dieser ist jedoch nicht gleich und lässt sich mittels des Hebelgesetzes bestimmen. Ebenfalls zeigt ein solches Zustandsdiagramm, dass Legierungen keinen festen Schmelzpunkt haben sondern ein Intervall zwischen Solidus- und Liquiduslinie. Nur die reinen Elemente A und B besitzen einen festen Schmelzpunkt. Beispiele sind Ag-Au, Au-Pt, Cu-Ni, Co-Ni und Cu-Pt.
Vollständige Löslichkeit im flüssigen und Nichtlöslichkeit im festen Zustand = System mit eutektischer Entmischung
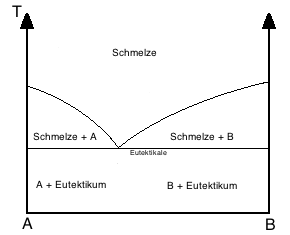
Das System zeigt einen besonders niedrig Schmelzenden Punkt unterhalb der Schmelztemperaturen der Komponenten A und B –> Eutektischer Punkt. Dieses Phänomen nutzt man z.B. bei Lötzinn aus, da Lötzinn ja niedrigschemlzend sein soll.
Die Eutektische Reaktion Schmelze → A + B sagt aus, dass bei einer bestimmten Konzentration aus der Schmelze bei überschreiten der Eutektikale A- und B-Kristalle zu einem feinkristallinen Kristallgemisch erstarre welches man Eutektikum nennt. Beispiele sind Bi-Cd und Pb-Sb.
Vollständige Löslichkeit im flüssigen und beschränkte Löslichkeit im festen Zustand
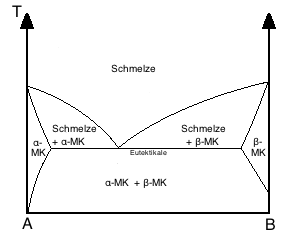
Das System bildet Mischkristalle, jedoch nicht in jeder Zusammensetzung. Innerhalb der Mischungslücke liegt dann ein Kristallgemisch aus Mischkristallen vor. Die Eutektische Reaktion ist hier Sm → α + β.
Die Linien, die die Einphasengebiete α und β von dem Gebiet der Kristallgemische aus Mischkristallen abgrenzen, heißen Löslichkeits- bzw. Sättigungslinien. Beispiele sind Ag-Cu, Pb-Sn, Al-Cu, Al-Si und Cd-Sn.
Peritektisches System

Anders wie in den bisher behandelten Zweistoffsystemen, ist die Mischkristallbildung im peritektischen System nicht mit der Bildung eines Eutektikums verbunden. Das System weist zwar eine waagrechte Linie ( = Peritektikale) auf, aber kein Minimum in der Liquiduslinie.
Die Umsetzung von Sm + α → β wird als peritektische Umwandlung bezeichnet. Die Umwandlung erfolgt direkt an den Grenzflächen zwischen Schmelze und Primärkristallen. Beispiel ist z.B. die Umwandlung δ-Fe im Fe-Fe3C-Diagramm.
Des Weiteren gibt es auch noch Intermetallische Verbindungen. Intermetallische Verbindungen sind im Allgemeinen hart, spröde und chemisch leicht angreifbar. Derartige Legierungen werden daher normalerweise vermieden aber manche haben auch positive Auswirkungen, wie z.B. Aluminium-Legierungen.
Legierungssysteme mit intermetallischen Verbindungen lassen sich zum Teil auf zusammengesetzte binäre Systeme zurückführen. Sie können ein Schmelztemperatur-Maximum oder ein verdecktes Maximum enthalten. Ein einfaches System ist z.B. eines aus zwei nebeneinander zusammengesetzten eutektischen Zustandsdiagrammen.
